慢性胃炎及上皮性肿瘤胃黏膜活检病理诊断共识
一、关于内窥镜下活检的建议
1.常规胃黏膜活检:建议取5块活检,2块取自距幽门2~3 cm的胃窦处(1块取自胃小弯远端,另1块取自胃大弯远端),2块取自距贲门8 cm处的胃体(1块取自胃小弯,1块取自胃大弯),1块取自胃角。取自不同部位的标本应该分开放置,并将部位标记清楚。
2.怀疑早期肿瘤性病变的胃黏膜活检:由于早期胃癌及高级别上皮内肿瘤目前可进行内镜下切除治疗,反复/多点活检后局部纤维组织增生粘连会给后续内镜治疗带来困难,内镜切除后标本也会因多点活检造成病理诊断困难。一般建议直径2 cm以下病变取1~2块活检,直径每增加1 cm可增加1块活检,最好取正常和病变交界部的黏膜,以便于病理医师对病变的诊断。当病变的边界不好确定时,可在病变中央部位活检,如必要可适当增加活检数量。
3.倾向进展期癌的胃黏膜活检:建议在内镜下明确肿瘤区域,避开坏死部分,取材6~8块活检,以增加活检阳性率,并备HER2检测。
4.早期肿瘤性病变需确定病变范围和进展期癌需确定手术范围的活检,建议根据临床的实际需要进行多点活检。
5.内窥镜医师应注意到标本取材后的定向问题,用小镊子从黏膜钳子中取出标本后,应先仔细认清标本的方向,然后将标本的基底面贴到固定用的小纸片上。否则,做出的病理切片有看不到黏膜纵切面的可能。粘在小纸片上的标本应立即投入充足(大于10倍标本体积)的3.7%中性缓冲甲醛液中,固定时间不应少于6 h。
6.患者的临床病史、内镜所见、活检部位等信息应当完整地提供给病理医师。
二、关于病理取材、切片和染色的建议
1.要严格遵守查对制度,即核对患者姓名、取材部位、取材块数、编号是否有误,检查器械、台面、捞片水面有无污染物。防止张冠李戴、组织遗漏、标本交叉污染而造成的漏诊、误诊。
2.病理医师在取材时应滴加伊红或其他染料于胃黏膜标本上,以便观察,每个包埋盒内不宜超过3块标本。标本固定时间为6~48 h。
3.包埋时,烧烫的镊子不能直接接触标本,先在蜡面减热后再夹取组织,防止灼伤组织。
4.包埋时要注意包埋面,争取立埋。
5.每个蜡块要切6~8片组织。
6.注意辅助染色的应用,在有炎性改变的标本中,应适当进行针对幽门螺杆菌(H. pylori,HP)的免疫组织化学标记或特殊染色。需要识别肠上皮化生时,可进行阿辛蓝过碘酸雪夫(AB-PAS)染色,或免疫组织化学CD10、MUC2染色等。
三、关于胃炎病理诊断的建议
各种病因所致的胃黏膜炎性病变称为胃炎。临床发病迅速,以中性粒细胞浸润为主,伴充血、糜烂等表现时称为急性胃炎,以淋巴细胞、浆细胞浸润为主时称为慢性胃炎。当胃黏膜在淋巴细胞、浆细胞浸润的同时见到中性粒细胞浸润时,称为慢性“活动性”胃炎或慢性胃炎伴活动。慢性胃炎根据固有腺体有无减少,分为非萎缩性胃炎和萎缩性胃炎两类;按照病变部位分为胃窦胃炎、胃体胃炎和全胃炎。另有少部分特殊类型的胃炎或胃病,如化学性胃炎、淋巴细胞性胃炎、肉芽肿性胃炎、嗜酸细胞性胃炎、胶原性胃炎、放射性胃炎、感染性(细菌、病毒、霉菌和寄生虫)胃炎和巨大肥厚性胃炎(Menetrier病)等,强调病理诊断必须结合临床病史、病因和内窥镜所见。
对于最常见的慢性胃炎,需评估5种组织学变化(HP、慢性炎性病变、活动性、萎缩和肠上皮化生),每种组织学改变评估程度,分为无、轻度、中度和重度4级(0、+、++、+++)。分级方法用下述标准,与新悉尼系统的直观模拟评分法(visual analogue scale)并用,病理诊断要报告每个部位活检标本的组织学变化。
1.HP:
观察胃黏膜黏液层、表面上皮、小凹上皮和腺管上皮表面的HP(图1A)。无:特殊染色片上未见HP;轻度:偶见或小于标本全长1/3有少数HP;中度:HP分布超过标本全长1/3而未达2/3或连续性、薄而稀疏地存在于上皮表面;重度:HP成堆存在,基本分布于标本全长。肠上皮化生黏膜表面通常无HP定植,宜在非肠上皮化生处寻找。对炎性病变明显而HE染色切片未见HP的,要作辅助染色仔细寻找,可以使用免疫组织化学染色或Giemsa染色,也可按各病理室惯用的染色方法进行检测
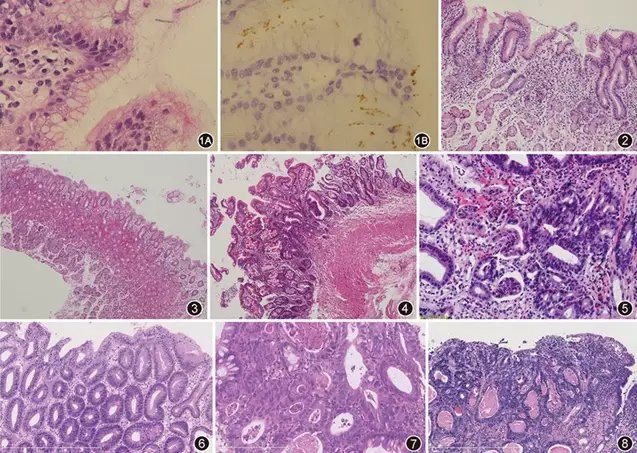
图1A幽门螺杆菌定植于胃表面黏液中,高倍镜可见细小灰色的小杆菌 HE 高倍放大;
图1B免疫组织化学染色标记幽门螺杆菌阳性 EnVision法 高倍放大;
图2慢性活动性胃炎,固有膜内见淋巴细胞、浆细胞及中性粒细胞浸润,并见中性粒细胞浸润上皮,判为中度活动性炎 HE 中倍放大;
图3慢性胃炎,固有膜淋巴细胞、浆细胞浸润,炎细胞量较少,位于表层,判为轻度慢性炎 HE 低倍放大;
图4慢性萎缩性胃炎,活检胃黏膜大部分肠上皮化生,固有腺体减少,判为重度肠上皮化生、重度萎缩,诊断慢性萎缩性胃炎 HE 低倍放大;
图5不确定的上皮内肿瘤,黏膜固有膜内及上皮内有大量中性粒细胞浸润,腺体拥挤,细胞核大,核质比升高,核深染 HE 中倍放大;
图6低级别上皮内肿瘤,腺管密集,但无复杂结构,细胞核瘦长,拥挤,深染,靠近腺管基底部 HE 中倍放大;
图7高级别上皮内肿瘤,腺管大小不等,不规则分支,细胞核圆形或椭圆形,排列紊乱,可见明显核仁 HE 高倍放大;
图8癌,腺管结构复杂,大小不等,互相吻合,并见多灶小团细胞在间质浸润,细胞核异型性明显,呈高级别特征,可见腺腔内坏死 HE 中倍放大。
2.活动性:
慢性炎性病变背景上有中性粒细胞浸润。轻度:黏膜固有层有少数中性粒细胞浸润;中度:中性粒细胞较多存在于黏膜层,可见于表面上皮细胞、小凹上皮细胞或腺管上皮内;重度:中性粒细胞较密集,或除中度所见外还可见小凹脓肿(图2)。
3.慢性炎性病变:
根据黏膜层慢性炎性细胞的密集程度和浸润深度分级,二者不一致时以前者为主。正常:单个核细胞(淋巴细胞、浆细胞和单核细胞)每高倍视野不超过5个,如数量略超过正常而内窥镜下无明显异常,病理可诊断为基本正常;轻度:慢性炎性细胞较少并局限于黏膜浅层,不超过黏膜层的1/3;中度:慢性炎性细胞较密集,不超过黏膜层的2/3;重度:慢性炎性细胞密集,占据黏膜全层。计算密度程度时要避开淋巴滤泡及其周围的小淋巴细胞区(图3)。
4.萎缩:
萎缩指胃固有腺减少,分为两种类型:
(1)化生性萎缩:胃固有腺被肠上皮化生腺体或被假幽门化生腺体替代;
(2)非化生性萎缩:胃固有腺被纤维或纤维肌性组织替代,或炎性细胞浸润引起固有腺数量减少。萎缩程度以胃固有腺减少各1/3来计算。轻度:固有腺体数减少不超过原有腺体的1/3;中度:固有腺体数减少介于原有腺体的1/3~2/3之间;重度:固有腺体数减少超过2/3,仅残留少数腺体,甚至完全消失(图4)。局限于胃小凹区域的肠上皮化生不能计入萎缩。黏膜层出现淋巴滤泡的区域不用于评估萎缩程度,应观察其周围区域的腺体情况来决定。所有原因引起黏膜损伤的病理过程都可造成腺体数量减少,如活检取自溃疡边缘,腺体减少不一定代表萎缩性胃炎。标本过浅未达黏膜肌层者可参考黏膜层腺体大小和密度以及间质反应情况推测是否萎缩,同时加上取材过浅的评注,提醒临床医师仅供参考。
5.肠上皮化生:
轻度:肠上皮化生区占腺体和表面上皮总面积1/3以下;中度:肠上皮化生区占腺体和表面上皮总面积的1/3~2/3;重度:肠上皮化生区占腺体和表面上皮总面积的2/3以上(图4)。AB-PAS染色或免疫组织化学CD10、MUC2对不明显肠上皮化生的诊断很有帮助。以AB-PAS黏液染色区分肠上皮化生亚型预测胃癌发生危险性的价值仍有争议。
6.其他组织学特征:
出现不需要分级的组织学变化时需注明,分为非特异性和特异性两类。前者包括淋巴滤泡、小凹上皮增生、胰腺化生和假幽门腺化生等,后者包括肉芽肿、密集的嗜酸性粒细胞浸润、明显上皮内淋巴细胞浸润和特异性病原体等。假幽门腺化生是泌酸腺萎缩的指标,判断时要核实取材部位,胃角部活检见到黏液分泌腺不宜诊断为假幽门腺化生。
病理诊断应包括部位分布特征和组织学变化程度,有病因可循的要报告病因。萎缩性胃炎的诊断标准:只要慢性胃炎的病理活检显示固有腺体萎缩即可诊断为慢性萎缩性胃炎,而不需考虑活检标本出现萎缩的标本块数和萎缩程度。临床医师可根据病理结果并结合内窥镜所见,最后做出萎缩范围和程度的判断。
四、关于胃上皮性肿瘤及其前驱病变的分类和诊断建议
(一)名词及含义
1.异型增生(dysplasia):
上皮有明显的细胞和/或结构异常,呈现肿瘤生长性质,无固有膜浸润。
2.不典型性(atypia):
因炎性病变等原因导致上皮呈现反应性的增生,组织学可出现细胞和结构异常,但无肿瘤性质。可应用“不典型增生”来表达,但因易造成混淆,实际工作中并不建议使用“不典型增生”的词语,而应用描述性词语,如“不典型性改变”、“反应性不典型性”等。
3.上皮内肿瘤(intraepithelial neoplasm):
细胞学和组织学存在改变,这些改变可反映出能够引发浸润性癌的潜在分子学异常[3]。胃黏膜上皮内肿瘤具有细胞和结构的异常,具有明确肿瘤性增生特征,但尚无侵袭性生长的证据。胃黏膜的上皮内肿瘤与异型增生含义相近,推荐使用“上皮内肿瘤”的诊断用语。
(二)胃黏膜活检病理报告推荐采用5级分类系统
胃黏膜活检病理报告推荐采用5级分类系统,在镜下描述之后进行进一步分类,便于临床医师处理。基于维也纳/WHO 2010分类系统,方法简单易行,可重复性强,综合了东西方国家的诊断经验,使得临床医师与病理医师能够很好地沟通,尤其是有利于癌前病变的诊断和处理。
下列情况不能用于诊断:
(1)无法分类:活检标本不能满足活检组织诊断。
(2)活检标本中没有上皮成分(即临床没有活检到组织或因脱水等造成的组织丢失)。即使活检到了上皮成分,但因为热凝固和组织明显挤压等,标本不能进行活检诊断。具体分类如下。
1.无上皮内肿瘤,即正常组织及非肿瘤性病变。包括正常组织、化生性黏膜、炎性黏膜、增生性黏膜等情况。当出现糜烂、溃疡、增生性息肉等再生性改变/反应性改变时,若能判断为非肿瘤性改变,也包括在该组中。
2.不确定的上皮内肿瘤,即诊断肿瘤(腺瘤或癌)性病变还是非肿瘤性病变困难的病变。诊断该组病变要告知临床医师诊断困难的理由。理由一般分为以下3种:
(1)可见形态异常细胞,但组织量不够,从细胞异型性上很难判断是肿瘤性异型性还是反应性导致的形态改变(临床应重新活检,需要确定性诊断)。
(2)可见形态异常细胞,但糜烂和炎性改变很明显,是肿瘤性病变还是非肿瘤性病变判断困难的病例(临床需消炎治疗后重新活检,要充分进行随访、观察;图5)。
(3)可见形态异常细胞,但组织挤压和损伤明显,是肿瘤性病变还是非肿瘤性病变诊断困难的病例(临床应重新活检,需要确定性诊断)。当诊断为此类病变时,病理医师首先应深切或连续切片,必要时加做免疫组织化学Ki-67、p53等染色辅助诊断,但应注意免疫组织化学染色的价值有限,最终诊断应依据HE切片做出。当该病例再次活检还考虑为此类时,建议进行专科病理会诊。
3.低级别上皮内肿瘤。该组病变为肿瘤性病变,但发展为癌的几率较低,可随诊或局部切除。组织形态学与周围组织有区别。表现为腺体拥挤、密集,但多数为圆形、椭圆形腺体,很少有复杂的分支或乳头状结构。细胞核杆状、拥挤、深染、无明显核仁,呈单层或假复层,位于腺管的近基底部,细胞核的极向仍保持。核分裂象可增多,无病理性核分裂象(图6)。
4.高级别上皮内肿瘤。该组病变为肿瘤性病变,形态与上皮内的癌难以区分,发生浸润及转移的风险很高,应局部或手术切除。病变与周围组织形态学变化截然不同。腺体的结构混乱,除密集拥挤外,常见复杂的分支和乳头状结构,大小差距显著。细胞核多形性明显,近圆形且不规则,深染,核质比增大,易见明显核仁。单层或多层排列,且细胞核的方向混乱,极向消失。可以见到病理性核分裂象(图7)。当出现不确定的浸润时,可归入“高级别上皮内肿瘤,可疑浸润”。
5.癌。出现浸润时,诊断为癌。当出现黏膜固有膜及黏膜肌层浸润时,称“黏膜内浸润性癌/黏膜内癌”。早期的浸润,组织学表现仍有争议。单个或小团肿瘤细胞出现在间质中,无腺管样结构,可判断为浸润。此外,广泛的筛状,广泛复杂多分支的腺管样结构,腺体互相融合呈迷路状,均可认为是浸润的形态学表现。腺腔内坏死虽不能诊断浸润,但是很重要的提示指标(图8)。
明确出现黏膜下层浸润时诊断为黏膜下浸润癌。除在标本中明确见到癌浸润黏膜下层外,癌周出现明显的促间质纤维结缔组织增生反应,也是黏膜下层浸润的证据。应报告组织学类型,当存在两种肿瘤组织学类型时,按组织类型从多到少的顺序写报告。应报告有无脉管瘤栓。
病理诊断明确为癌的病例推荐行HER2免疫组织化学染色或荧光原位杂交检测,为患者提供靶向治疗及预后的依据。
需注意不要将低、高级别上皮内肿瘤与以前的轻、中、重度异型增生直接对应。两种体系的判断标准不完全相同,其中“中度异型增生”混杂有不同性质的病变,因此两种体系无法直接对应。推荐按照低、高级别上皮内肿瘤的分类体系并按照相应诊断标准予以判断。
针对胃黏膜活检标本的特点,规范地获取和处理标本,推行悉尼胃炎分类标准和肿瘤性病变5级分类标准,将有助于提高不同病理医师对胃黏膜病理诊断的准确性和可重复性,进而为临床治疗提供规范化与一致性的病理诊断依据。

