滤泡性淋巴瘤(FL)是一种滤泡生发中心B细胞转化来的惰性成熟B细胞非霍奇金淋巴瘤(NHL),发病率仅次于弥漫大B细胞淋巴瘤(DLBCL),占美国所有成人NHL的20-40%,在欧洲和亚洲较少见。
FL通常发生在老年患者,中位年龄是65岁,中位生存时间超过10年,男女比例1:1.7。多呈现广泛性无痛性淋巴结肿大,诊断时多已弥漫性侵润,累及多个淋巴结、韦氏环、肝脏、脾脏,40-70%可发生骨髓侵犯。原发病灶还包括皮肤、胃肠道[1,2]、眼附属器、甲状腺[3]、胰腺[4]、腮腺[5]、乳房[6]、输尿管、睾丸,也有FL转移到中枢系统、同一器官FL和其它恶性肿瘤共存的病例[6,7]。
2016年WHO更新分类中,原位病变的滤泡淋巴瘤更名为原位滤泡肿瘤(ISFN)。ISFN进展率低,常与先行的或同时发生的明显淋巴瘤相关,因此需要另外的临床评估。修订分类中,儿童FL为一个明确病种,称为儿童型FL。
发病机制及转化
约90%的病例显示t(14;18)(q32;q21)易位,14号染色体上的免疫球蛋白(IGH)基因座与18号染色体上的BCL2基因融合,导致BCL2的过度表达,使位于线粒体中的BCL2通过阻止细胞凋亡来促进细胞存活,进而形成肿瘤。约10-15%的FL病例BCL2阴性。遗传学上也显示,FL的肿瘤细胞与免疫微环境和间质细胞之间相互作用在淋巴瘤形成与预后方面发挥着非常重要的作用。
组织学转化是在惰性淋巴瘤进展为侵袭性淋巴瘤的过程中发生的重要生物学事件,在多种惰性非霍奇金淋巴瘤中均可发生。滤泡性淋巴瘤(FL)的组织学转化所进行的研究最为深入,尤其是转化为弥漫大B细胞淋巴瘤(DLBCL)。转化后的滤泡性淋巴瘤(tFL)侵袭性高、预后差。驱动转化发生的机制并非单一的,而是涉及细胞遗传学异常及基因突变等多个层面。在转化时获得的遗传学异常中,CDKN2A/B缺失最为常见,其次是MYC相关的遗传学异常[8]。
分级
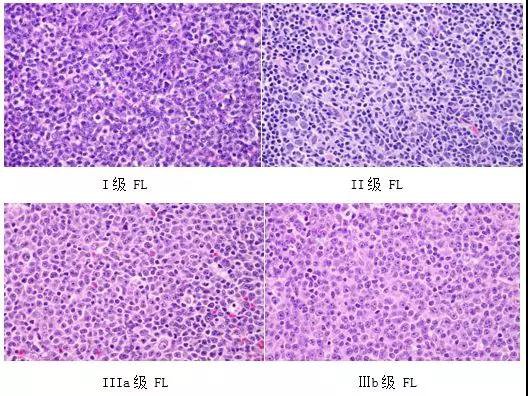
滤泡性淋巴瘤细分为3级,预后随着中心母细胞数量的增加而恶化。WHO根据在随机选择的滤泡中中心母细胞在10到20个高倍视野(40x)的数量将FL分为I-III级,其中III级又分为IIIa、Ⅲb级(表1)。
表1 WHO FL分级

形态学
FL是由滤泡中心B细胞(中心细胞和中心母细胞)组成,最显著的形态特征是结节(滤泡)模式,在晚期由于弥散生长模式而消失。肿瘤细胞由小和大的淋巴细胞混合而成。 中心细胞(小有裂滤泡中心细胞),不规则,有皱褶和凹陷,染色质粗糙,核仁不明显,胞浆少;中心母细胞(大无裂滤泡中心细胞),较大的细胞,核圆形,核仁明显,细胞质中等。滤泡性树突状细胞(非肿瘤性)也可在肿瘤滤泡内发现。在约10%的病例中可见外周血受累。
图片来源:webpathology
免疫表型
FL细胞通常表达CD10、CD19,CD20,CD22,CD79a、HLA-DR、BCL2、BCL6,表达单克隆免疫球蛋白,CD5、CD11c、CD43、CD23是阴性的。值得注意的是CD10和BCL6是最常用的生发中心标记,一旦滤泡外阳性细胞明显增多,提示滤泡可能不正常,这在诊断BCL2阴性滤泡性淋巴瘤时非常有价值。
治疗
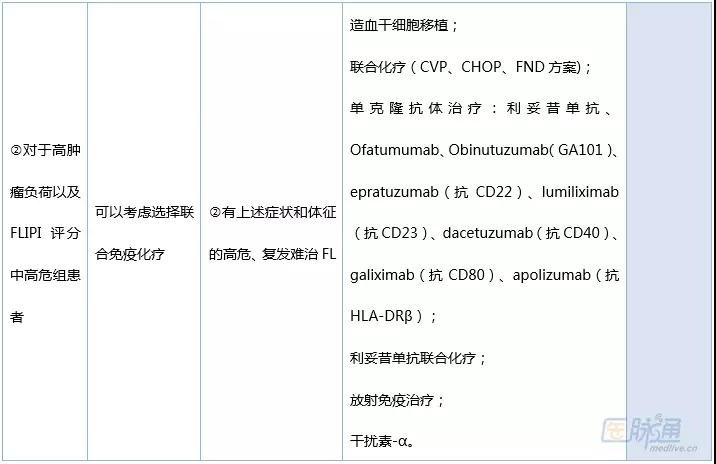
FL常通过综合患者的Ann Arbor病理分期、FL国际预后指数评分、GELF肿瘤负荷标准和相关治疗指标等因素进行个体化治疗,最大限度延长生存期,提高患者的生活质量为目标。近年来,随着治疗方案的改进和新药的问世,FL患者的无进展生存(PFS)率、总生存(OS)率均得到了显著提高。
表2 FL的治疗

预后
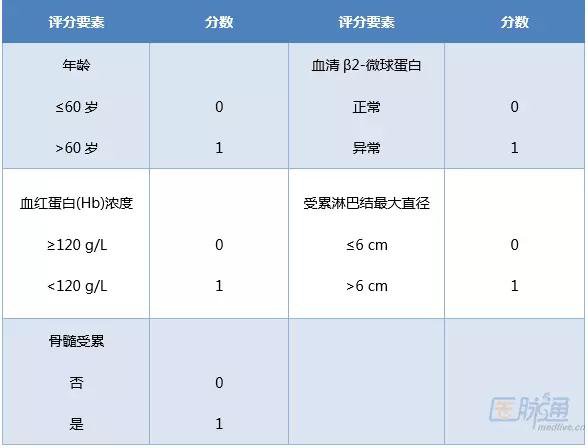
预测FL患者预后,通常采用FL国际预后指数(FLIPI)评分标准。近年随着抗CD20单抗治疗FL应用的日益普遍,新的临床预后评分系统FLIPI-2显示出优于FLIPI-1的优势。
表3 FL国际预后指数(FLIPI)-1评分标准

注:各项之和0-1分为低危,2分为中低危,3分为中高危,4-5分为高危[9]表4 FL国际预后指数(FLIPI)-2评分标准
随着对淋巴瘤发病机制研究的不断深入,新的治疗药物不断出现,靶向药物单药或与传统化疗药物合用,将进一步提高FL患者的疗效和生活质量,提高无进展生存期及总体生存率。
附:发生在不同部位的滤泡性淋巴瘤(FL)
例1 原发于十二指肠的FL[1]。
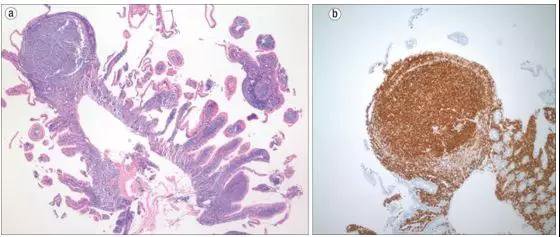
图1 十二指肠滤泡性淋巴瘤的形态学。(a)用H-E染色的滤泡性淋巴瘤(× 40)。(b)用Bcl-2抗体染色的滤泡性淋巴瘤(× 100)。
例2 原发于小肠的FL[2]。
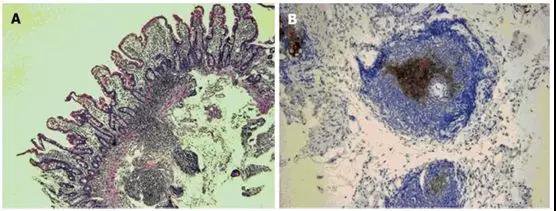
图2 小肠活组织检查样本的病理评估。(A)形成淋巴滤泡并渗入绒毛的中小淋巴细胞单一性增殖。 (B)淋巴瘤细胞CD10表达阳性。
例3 原发于甲状腺的FL[3]。
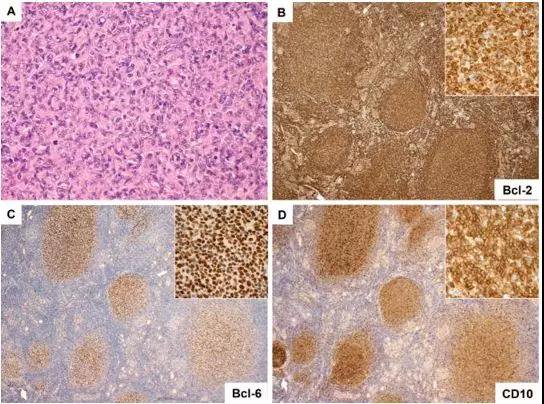
图3 甲状腺滤泡性淋巴瘤具有Bcl-2表达/ IGH-BCL2特征。(A)大多数这些淋巴瘤由WHO 1或2级肿瘤滤泡组成;(B)生发中心细胞通常表达Bcl-2,(C)Bcl-6和(D)CD10。
例4 原发于胰腺的FL[4]。
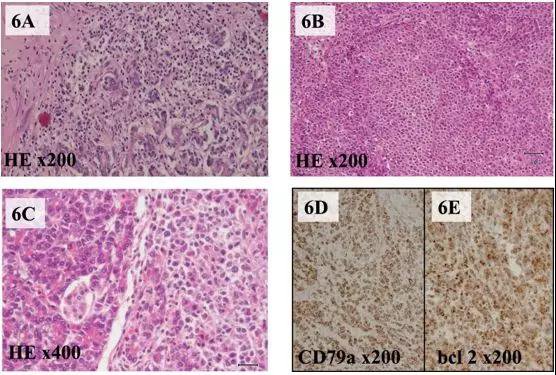
图4 (A)H-E染色显微镜检查,显示急性胰腺炎,胰尾有淋巴细胞浸润实质。(B)H-E染色显示滤泡性淋巴瘤细胞。(C)累及外分泌胰腺和Langerhans胰岛实质的淋巴瘤细胞。CD79a免疫染色(D)和bcl-2免疫染色(E)均为阳性。
例5 原发于腮腺的FL[5]。
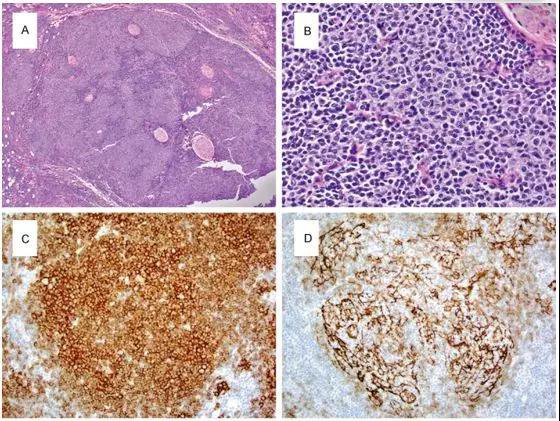
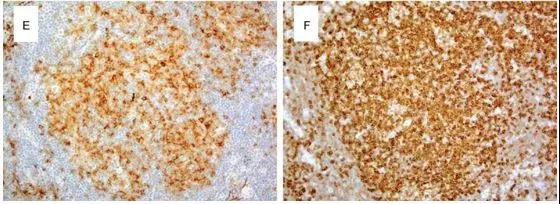
图5 腮腺滤泡性淋巴瘤的形态学。(A)低放镜显示淋巴细胞浸润形成许多不规则形状的肿瘤滤泡;(B)肿瘤细胞大小不等,核轮廓不规则,核仁不明显(中心细胞);(C)滤泡内的肿瘤细胞是CD20 + B细胞;(D)CD21突出了滤泡树突状网状物的扩大;(E)淋巴瘤细胞共表达CD10和(F)BCL-2。
例6 原发于乳腺的FL[6]。
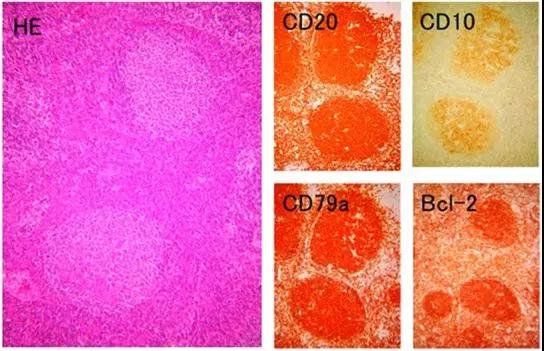
图6 发生在乳腺的FL的病理学和免疫组织化学(×100)。肿瘤细胞CD20,CD79a,CD10和Bcl-2蛋白阳性。
例7 腺癌和淋巴瘤共同侵犯淋巴结[7]。
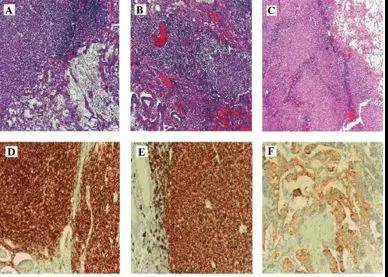
图7 显微照片表明腺癌和淋巴瘤在同一淋巴结切片上共存(×100)和(B)盲肠部粘蛋白丰富的非典型腺体和滤泡性淋巴瘤(×100)和(C)淋巴结(×40)。免疫组织化学染色(D)CD10阳性(×200)和淋巴结(E)CD20阳性(×200)及(F)pancytokeratin在盲肠腺癌成分阳性(×200)。

